Der ungetrübte Blick in die Zelle
Durch die Kombination neuester Entwicklungen im Bereich der Kryo-Elektronentomografie haben Wissenschaftler vom Max-Planck-Institut für Biochemie in Martinsried bisher verborgene Strukturen rund um den Zellkern von HeLa-Zellen in dreidimensionalen Bildern sichtbar gemacht. So zeigen sie im Fachjournal Science das erste Mal die Kernlamina, eine drei Nanometer dünne, fadenartige Proteinstruktur, die den Zellkern umgibt. Ohne die Zellen zu fixieren, also chemisch zu verändern oder zu entwässern, werden die zellulären Bestandteile in ihrer natürlichen Umgebung gezeigt. Erst dadurch kann das Zusammenspiel der funktionellen Bestandteile einer Zelle erkannt und verstanden werden.
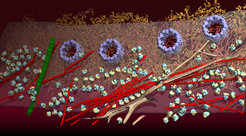
Durch die Kombination technischer Entwicklungen in der Kryo-Elektronentomografie können verschiedene Bestandteile der Zelle in ihrer natürlichen Umgebung sichtbar gemacht werden.
Dank neuester Technologien können Wissenschaftler in immer kleinere Welten vordringen. So ist es das Ziel der Arbeitsgruppe um Wolfgang Baumeister, Leiter der Abteilung „Molekulare Strukturbiologie“ am Max-Planck-Institut für Biochemie, die kleinsten zellulären Strukturen in ihrer natürlichen Umgebung sichtbar zu machen. Federführend in der Entwicklung der Kryo-Elektronentomografie, sind die Forscher mittlerweile in der Lage größere Moleküle wie DNA oder einzelne Proteinkomplexe in dreidimensionalen Bildern aufzunehmen und zu analysieren.
„Eine Zelle besteht zu 90% aus Wasser. In klassischen elektronenmikroskopischen Bildgebungsverfahren werden die Zellen fixiert, entwässert, angefärbt und so chemisch verändert. Dadurch entstehen Artefakte und der natürliche, funktionelle Zusammenhang der einzelnen zellulären Bestandteile geht verloren“, erläutert Julia Mahamid, Erstautorin der Veröffentlichung. „Innerhalb der letzten fünf Jahre haben sich verschiedene Techniken soweit verbessert, dass wir jetzt das erste Mal die drei Nanometer (nm) dünne Kernlamina sehen können“, so Mahamid weiter. Diese Schicht besteht aus dünnen fadenartigen Proteinen und stützt in den Zellen die Struktur des Zellkerns. Auf ihren 3D-Bildern können die Wissenschaftler auch Kernporen, also die Portale vom Zellkern in das Zellplasma sehen, Ribosomen - die Proteinfabriken der Zellen - oder Teile des Zellskelettes, wie Mikrotubuli, Intermediärfilamente und Aktin.
Für die Kryo-Elektronentomografie werden Zellen schockgefroren. Dadurch gefriert das Wasser in einem glasartigen Zustand, und es entstehen keine Eiskristalle, die die molekularen Strukturen zerstören würden. Ähnlich der Computertomografie in der medizinischen Diagnostik, werden zweidimensionale Bilder aus verschiedenen Blickwinkeln aufgenommen, im Bereich der Strukturbiologie mit dem Transmissions-Elektronenmikroskop. Die zelluläre Landschaft wird dann aus den aufgenommenen Bildern am Rechner wieder zu dreidimensionalen Volumen zusammengesetzt. Einen wesentlich erhöhten Kontrast erhalten die Wissenschaftler dabei durch die am Institut kürzlich entwickelte Volta-Phasen-Platte, die jetzt die Einblicke in den dicht gepackten Zellkern ermöglicht.
Für die Transmissions-Elektronenmikroskopie werden sehr dünne Proben benötigt. „Aus den schockgefrorenen, mehreren Mikrometer dicken menschlichen Zellen werden etwa 200 nm dünnen Zellschnitte mit Hilfe eines fokussierten Ionenstrahls hergestellt“ erklärt Mahamid, eine Methode, die bislang hauptsächlich in der Materialwissenschaft angewandt wurde. Dieses Verfahren lässt die molekularen Strukturen im glasartigen Zellschnitt unverändert, im Gegensatz zu mechanischen Schnitten.
„Das Projekt ist ein Ergebnis aus dem Zusammenspiel vieler Innovationen, die in den letzten Jahren etabliert wurden und beruht auf der gemeinsamen Leistung vieler Wissenschaftler“, erklärt Mahamid. „In Zukunft können viele zelluläre Prozesse auf molekularer Ebene in der natürlichen Umgebung sichtbar gemacht werden“.
Originalpublikation:
J. Mahamid, S. Pfeffer, M. Schaffer, E. Villa, R. Danev, L. Kuhn-Cuellar, F. Förster, A. A. Hyman, J. M. Plitzko, W. Baumeister: Visualizing the molecular sociology at the HeLa cell nuclear periphery, Science, Februar 2016
DOI: 10.1126/science.aad8857












