Neuartiger Mechanismus zur Aufrechterhaltung der bakteriellen Proteostase identifiziert
Forscher am Max-Planck-Institut für Biochemie (MPIB) haben einen neuartigen Mechanismus identifiziert, der die Aufrechterhaltung der Proteostase in E. coli sicherstellt, wenn die Verfügbarkeit von Chaperonen begrenzt ist.
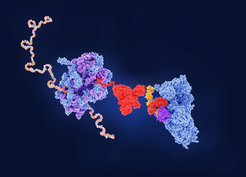
Wenn das Chaperon-Netzwerk defekt ist, wird RF3 ans Ribosom rekrutiert und vermittelt den Abbruch fehlgefalteter wachsender Polypeptidketten.
Erforschung des Chaperon-Netzwerks
Proteine - die Bausteine des Lebens - erfüllen in unserem Körper eine Vielzahl von Funktionen. Sie werden in der Zelle an großen Komplexen, den Ribosomen, synthetisiert. Dabei wird die Information der Boten-RNA in eine Sequenz von Aminosäuren übersetzt, die zu einer Polypeptidkette verbunden werden. Damit Proteine ihre Funktion erfüllen können, müssen diese wachsenden Polypeptidketten zu spezifischen dreidimensionalen Strukturen gefaltet werden. Wie können Zellen die korrekte Faltung ihrer Proteine sicherstellen? An dieser Stelle kommen Chaperone ins Spiel. Die Faltungshelfer sorgen dafür, dass Proteine richtig gefaltet werden, reparieren fehlgefaltete Proteine und leiten den Abbau fehlerhafter Proteine am Proteasom ein.
Mit Hilfe der quantitativen Proteomik verschafften sich Liang Zhao (Postdoktorand in den Arbeitsgruppen von F.-Ulrich Hartl und Manajit Hayer-Hartl) und das Team zunächst einen Überblick über das Chaperon-Netzwerk in dem Modellorganismus Escherichia coli (E. coli). Sie analysierten Proteine aus E. coli mittels Massenspektrometrie und identifizierten dabei eine Vielzahl von Chaperonen, die für die Proteinfaltung auf co-translationaler Ebene wichtig sind. Sie stellten fest, dass Triggerfaktor (TF), DnaJ und DnaK die am häufigsten vorkommenden Chaperone sind. Bei Funktionsverlust des zentralen Chaperons DnaK übernehmen die Chaperone HtpG, GroEL und ClpB zunehmend kompensatorische Aufgaben.
Defekte im Chaperon-Netzwerk führen zu einer Reaktion am Ribosom
Doch was passiert am Ribosom, wenn das Chaperon-Netzwerk defekt ist? Um dieser Frage nachzugehen, kooperierten die Forscher mit Pierre Genevaus und Marie-Pierre Castanié von der Universität Toulouse und schränkten die Zahl der in der Zelle verfügbaren Chaperone durch Knock-out-Modelle ein. Dadurch induzierten sie eine Fehlfaltung von wachsenden Polypeptidketten. Infolgedessen wurde der Release-Faktor 3 (RF3) an das Ribosom rekrutiert. RF3 interagierte daraufhin mit einem weiteren Faktor, RF2. Dies führte zu einem vorzeitigen Abbruch der Proteinsynthese und der Loslösung unvollständiger, fehlgefalteter Polypeptidketten vom Ribosom. Dadurch konnten die unvollständigen Polypeptidketten abgebaut werden. Wenn dagegen dieser Mechanismus durch Deletion von RF3 gehemmt wurde, reicherten sich fehlgefaltete Proteine an und lagerten sich zu Verklumpungen (Aggregaten) zusammen, welche die Synthese neuer Peptidketten behinderten. Somit konnte erstmals ein Zusammenhang zwischen einem Defekt von Chaperonen - oder einer Einschränkung von deren Verfügbarkeit - und einer daraus resultierenden Reaktion unter Beteiligung von RF3 am Ribosom nachgewiesen werden. Bei eingeschränkter Verfügbarkeit von Chaperonen ist dieser Mechanismus entscheidend für die Aufrechterhaltung der Proteostase, da er die Entfernung von fehlgefalteten Proteinen erleichtert.
Der nächste Schritt könnte die Identifizierung eines ähnlichen Mechanismus in Hefe- oder Säugetierzellen sein. Wenn ein analoger Mechanismus gefunden werden kann, könnte dies den Weg für zukünftige Behandlungen bei neurodegenerativen Krankheiten wie Alzheimer ebnen.
Originalpublikation:
L. Zhao, M.-P. Castanié-Cornet, S. Kumar, P. Genevaux, M. Hayer-Hartl, and F. Ulrich Hartl: Bacterial RF3 Senses Chaperone Function in Co-translational Folding, Molecular Cell, Juni 2021
DOI: https://doi.org/10.1016/j.molcel.2021.05.016












