Manajit Hayer-Hartl
Forschungsgruppe Chaperonin-vermittelte Proteinfaltung
Chaperonin, Proteinfaltung und -zusammenbau, Rubisco, GroEL und GroES, Massenspektrometrie
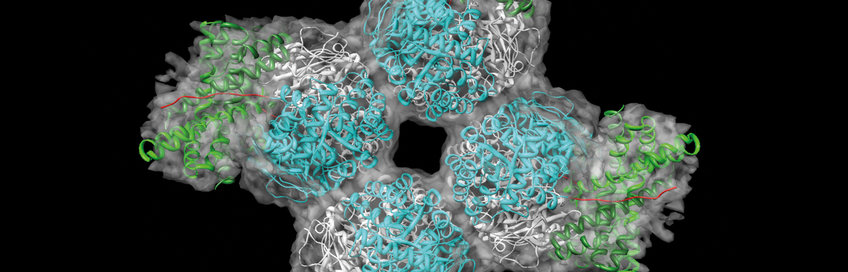
Nur mit ihrer korrekten dreidimensionalen Struktur können Proteine ihre Aufgaben erfüllen. Für die richtige Faltung in der Zelle sorgen „zelluläre Anstandsdamen“, die Chaperone. Sie können Wissenschaftlern aber auch dabei helfen, wichtige Proteine künstlich im Reagenzglas herzustellen. Manajit Hayer-Hartl und ihrer Forschungsgruppe „Chaperonin-vermittelte Proteinfaltung“ ist das bereits für das Schlüsselprotein der Photosynthese „RuBisCO“ gelungen. Die komplexe Struktur von RuBisCO (16 Untereinheiten) machte es bisher unmöglich, eine funktionsfähige Version des Proteins im Reagenzglas herzustellen. Mithilfe von Chaperonen und Helferproteinen ist es den Forschern gelungen einen funktionierenden RuBisCO-Komplex herzustellen.
Weiterführende Informationen zur Forschungstätigkeit der Forschungsgruppe „Chaperonin-vermittelte Proteinfaltung“ finden Sie auf der englischsprachigen Webseite
mehr
Besuchen Sie die Presseseite für allgemeine Informationen zum Forschungsgebiet, aktuelle News und zusätzliches Medienmaterial.
mehr