Tod durch Radikale
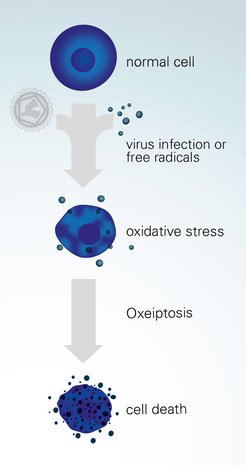
Virusinfizierte Zellen produzieren hohe Konzentrationen an freien Sauerstoffradikalen. Über das Zellsignalprogramm der Oxeiptose wird in diese Zellen in den kontrollierten Zelltod aktiviert.
Leben und Sterben gehört zu den existenziellsten Fragen einer Gesellschaft. Wie das Leben und Sterben in Zellen, der kleinsten Einheit des Lebens geregelt wird, beschäftigt viele Wissenschaftler. Es gibt eine Reihe von gut studierten Signalwegen, welche durch Reize von außer- oder innerhalb der Zelle zum sogenannten programmierten Zelltod führen. Je nach zellulärem Signal, kann es zu einer Immunreaktion kommen oder auch nicht.
Zu bekannten Auslösern des programmierten Zelltodes gehören unter anderem reaktive Sauerstoffradikale (reactive oxygen species, ROS). ROS wird in gesunden und in krankhaft veränderten Zellen gebildet. Hier gilt das Zitat von Paracelsus: „Die Dosis macht das Gift“. Sauerstoffradikale wirken in Zellen nur in hohen Dosen zerstörerisch. Forscher aus der Arbeitsgruppe von Andreas Pichlmair „Angeborene Immunität” am Max-Planck-Institut für Biochemie zeigen jetzt, dass das Eiweißmolekül KEAP1 die erhöhte Menge an Radikalen erkennen und den kontrollierten Zelltod einleiten kann.
Oxeiptose – Sauerstoffradikale führen zum kontrollierten Zelltod
„Generell war schon bekannt, dass KEAP1 als ROS Sensor fungiert“, erklärt Pichlmair. „Bei niedrigen Konzentrationen von ROS ändert KEAP1 so seine Struktur, dass die Produktion von zelleigenen Antioxidantien aktiviert wird. So kann ROS neutralisiert werden“. Durch diesen Mechanismus wird die Menge an intrazellulärem ROS reguliert. „Neu ist, dass KEAP1 bei hohen Mengen an ROS seine Funktion ändert und zu einem Zelltod-Vermittler wird“, so Pichlmair weiter. „Wir konnten Moleküle identifizieren, die in diesem Signalweg wichtig sind“. Wurden Bestandteile aus diesem Signalweg experimentell entfernt, überlebte die Zelle hohe Mengen an ROS. Da es sich hierbei um einen neuen, bisher unbekannten Signalweg handelt nennen die Wissenschaftler diesen „Oxeiptose“ – Tod hervorgerufen durch Sauerstoffradikale.
Oxeiptose bei Virusinfektionen
Pichlmair und Kollegen konnten zeigen, dass Oxeiptose auch bei viralen Infektionen aktiviert wird. Wurden Bestandteile des Oxeiptose-Signalweges ausgeschaltet überlebten Zellen eine Virusinfektion. „Wahrscheinlich hat sich dieser programmierte Zelltod in komplexen Organismen evolutionäre entwickelt, um den Organismus als Ganzes auf kosten einzelner Zellen zu schützen“, so Pichlmair. Die Bedeutung dieses Zelltodmechanismus wird dadurch unterstrichen, dass evolutionär unterschiedliche Viren entwickelt haben, welche diesen Signalweg aktiv modulieren können.
Wurden Mäuse mit dem Grippevirus Influenza infiziert, zeigten diese Entzündungsprozesse in der Lunge. Wenn in diesen Tieren ein essentieller Teil des Oxeiptose Signalweges fehlte, waren die Entzündungsprozesse hochgradig aggressiver. Bei Oxeiptose handelt es sich demzufolge um einen Zelltod, der entzündungshemmend wirkt. Können Zellen durch krankhafte Veränderungen in kritischen Komponenten diesen Zelltod nicht aktivieren, nimmt ein entzündliches Zelltod-Programm überhand und bewirkt so schwerwiegende Gewebeschäden.
Oxeiptose spielt wahrscheinlich bei vielen krankhaften Veränderungen eine Rolle. So wurde zum Beispiel bereits beschreiben dass essentielle Bestandteile des Oxeiptose Signalweges bei bestimmten Krebsarten mutiert sind. Die Wissenschaftler erhoffen durch die Identifizierung dieses Signalweges einen möglichen Weg gefunden zu haben zukünftig sowohl Infektionskrankheiten als auch entartete Krebszellen gezielt therapeutisch zu behandeln.
Originalpublikation
Holze C, Michaudel C, Mackowiak C, Haas DA, Benda C, Hubel P, Pennemann FL, Schnepf D, Wettmarshausen J, Braun M, Leung DW, Amarasinghe GK, Perocchi F, Staeheli P, Ryffel B, and Pichlmair A.: Oxeiptosis, an ROS-induced caspase-independent apoptosis-like cell-death pathway'. Nature Immunology, Dezember 2017
doi:10.1038/s41590-017-0013-y





