Katastrophenalarm in der Zelle (Artikel MaxPlanckForschung)
Max-Planck-Forscher identifizieren neue Mechanismen in der zellulären Stressantwort
Nach einer Naturkatastrophe wie einem Brand arbeiten unzählige Helfer zusammen, um Schutt zu beseitigen, behelfsmäßige Unterkünfte zu bauen und Hilfsbedürftige mit Lebensmitteln zu versorgen. Ist eine Zelle gefährlichen Umwelteinflüssen wie erhöhten Temperaturen oder giftigen Substanzen ausgesetzt, findet ein ganz ähnlicher Prozess statt: die zelluläre Stressantwort, auch Hitzeschockantwort genannt. Wissenschaftler vom Max-Planck-Institut für Biochemie in Martinsried bei München und der Technischen Universität Dresden konnten jetzt ein ganzes Netzwerk von zellulären Helfern aufdecken und so neue Regulationsmechanismen dieser Stressantwort identifizieren. „Unsere Ergebnisse könnten auch bei neurodegenerativen Krankheiten wie Alzheimer oder Parkinson helfen“, hofft Christian Loew, Doktorand am MPI für Biochemie. Die Studie wurde jetzt in dem Journal Cell veröffentlicht.
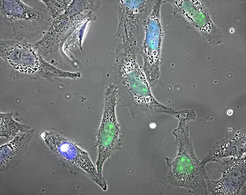
Wird eine Zelle lebensfeindlichen Bedingungen ausgesetzt, koordiniert das Protein HSF1 (grün markiert) ein Notfallprogramm, um die Zelle vor permanentem Schaden zu schützen.
Ist ein Organismus lebensfeindlichen Einflüssen ausgesetzt, schlägt er Alarm und ein zelluläres Notfallprogramm, die Hitzeschockantwort, wird gestartet. Der Name „Hitzeschockantwort“ ist dabei irreführend. Anfang der 60er Jahre wurde diese Form der Stressantwort das erste Mal beobachtet. Wissenschaftler setzten Fruchtfliegen erhöhten Temperaturen aus und beobachteten ein komplexes Notfallprogramm zum Schutz der einzelnen Zellen und damit des Organismus. Heute wissen die Forscher, dass dieses Programm auch bei anderen Gefährdungen wie Strahlung oder giftigen Substanzen ausgelöst wird. Der Begriff jedoch blieb.
Während der Hitzeschockantwort werden verschiedene Stressproteine produziert, die verhindern sollen, dass der Organismus dauerhaften Schaden erleidet. „Wie bei einem Katastrophenalarm werden Probleme und Schäden erkannt, Gegenmaßnahmen eingeleitet und koordiniert, um so den Ursprungszustand möglichst bald wiederherzustellen“, beschreibt Loew die Abläufe in der Zelle. Die Max-Planck-Wissenschaftler haben in einer umfangreichen Analyse 15.000 Proteine und ihre Rolle in der Hitzeschockantwort untersucht. Dabei stellten sie fest, dass die Helfer in verschieden Aufgaben und Katastrophengebiete eingeteilt werden. So gibt es beispielsweise Proteine, die im Zellkern überprüfen, ob die Erbsubstanz DNA noch intakt ist.
Die zentrale Steuerung des Katastrophenmanagements übernimmt das Protein HSF1 (engl. heat shock transkription factor). Wird es aktiviert, ruft es eine Vielzahl von anderen Proteinen auf den Plan, um bei der Beseitigung der Schäden zu helfen. Die Forscher konnten zwei Wege aufzeigen, wie diese Steuerzentrale selbst reguliert wird. Ist die Katastrophe überstanden, wird HSF1 durch die Müllabfuhr der Zelle, das Proteasom, abgebaut. Solange jedoch noch Schäden beseitigt werden müssen, verhindert ein anderes Protein (Acetyltransferase EP300) diesen Abbau.
Das Verständnis der Hitzeschockantwort könnte auch für die Therapie von neurodegenerativen Krankheiten wie Alzheimer oder Parkinson wichtig sein, hoffen die Forscher in Martinsried. Bei diesen Krankheiten ist die zelluläre Qualitätskontrolle durch die massiven Zellschäden überfordert. Nervenzellen sterben ab und können ihre Aufgaben im Gehirn nicht mehr übernehmen. „Eine gezielte Aktivierung der Hitzeschockantwort könnte eventuell die für diese Krankheiten typischen Zellschäden reduzieren“, erläutert Loew.
Originalpublikation:
S. Raychaudhuri, C. Loew, R. Körner, S. Pinkert, M. Theis, M. Hayer-Hartl, F. Buchholz and F. U. Hartl: Interplay of Acetyltransferase EP300 and the Proteasome System in Regulating Heat Shock Transcription Factor 1. Cell, February 27, 2014.
DOI: 10.1016/j.cell.2014.01.055












