Proteinsynthese in den Kraftwerken der Zelle
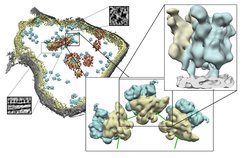
Links: Oberflächendarstellung eines Mitochondriums mit äußerer (grau) und innerer Mitochondrienhülle (gelb), lokalisierten Mito-Ribosomen (blau) und weiteren Proteinkomplexen (rot). Die kleinen Bilder zeigen einzelne Originalbilder. Mitte: Typische Anordnung der Mito-Ribosomen im Polysom. Blau dargestellt sind die großen, gelb die kleinen Untereinheiten der Mito-Ribosomen. Rechts: Struktur des Mito-Ribosoms (gelb, blau) gebunden an die innere Hülle (grau) eines intakten Mitochondriums.
Alle biochemischen Prozesse einer Zelle benötigen Energie, welche die Mitochondrien in Form des Energieträgers ATP zur Verfügung stellen. Für die Energieproduktion selbst benötigen die Mitochondrien Proteine. Doch wo kommen diese her? Der Großteil wird aus dem Zellplasma in das Innere der Mitochondrien transportiert. Ihre Bauanleitungen sind in der Erbsubstanz DNA im Zellkern gespeichert. Einige wenige Proteine, die zur Energieproduktion nötig sind, werden jedoch direkt in den Mitochondrien produziert – von sogenannten Mito-Ribosomen. Während die Architektur der Ribosomen im Zellplasma in den letzten Jahrzehnten intensiv erforscht wurde, begannen Forscher erst kürzlich die Struktur der Mito-Ribosomen näher zu untersuchen.
Wissenschaftlern der Forschungsgruppe „Modellierung von Proteinkomplexen“ gelang es jetzt erstmals, die Struktur des Mito-Ribosoms in seiner natürlichen Umgebung an der inneren Mitochondrienhülle zu beschreiben. Die Mito-Ribosomen lagern sich hier zu größeren Komplexen, sogenannten Polysomen, zusammen und produzieren so gemeinsam viele Proteinkopien. Die Forscher konnten auch zeigen, wie der Kontakt der Ribosomen mit der Mitochondrienhülle hergestellt wird: über das Membranprotein Mba1. „Wir glauben, dass Mba1 dabei nicht nur als Rezeptor für das Ribosom dient“, spekuliert Forschungsgruppenleiter Friedrich Förster, „sondern auch den Einbau der neu hergestellten Proteine in die Mitochondrienhülle unterstützt.“
Möglich sind derart detailreiche Einblicke in die Architektur und Kontakte des Ribosoms dank der Kryo-Elektronentomographie. Durch ein besonders schnelles Einfrieren auf minus 170°C bleibt die Struktur und die natürliche Anordnung der Ribosomen in der Zelle erhalten. Anschließend nehmen die Forscher eine Serie von Bildern unterschiedlicher Blickwinkel auf, die im Computer zusammengesetzt ein dreidimensionales Bild ergeben.
Originalveröffentlichung
Pfeffer, S., Woellhaf, M.W., Herrmann, J.M., Förster, F.: Organization of the mitochondrial translation machinery studied in situ by cryo-electron tomography. Nature Commun, January 22, 2015
Doi: 10.1038/ncomms7019



