Max-Planck-Forscher enträtseln molekularen Shuttleservice
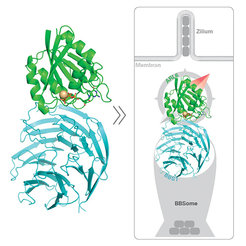
Nachdem das BBSome seine Fracht aufgenommen hat, bindet ARL6 (grün) an das Protein BBS1 (blau) und geleitet das BBSome in Richtung Zilium.
Zilien sind filigrane, haarähnliche Strukturen, die auf fast allen Zellen von Mensch und (Wirbel-) Tier vorkommen. Dort verrichten sie eine Fülle wichtiger Aufgaben: sie verarbeiten beispielsweise akustische Signale in unseren Ohren sowie optische Signale in unseren Augen und ermöglichen den Spermien die Fortbewegung. Dies lässt erahnen, wie wichtig diese Strukturen sind. Es verdeutlicht aber auch, wie stark Krankheiten, die die Zilien betreffen (sogenannte Ziliopathien), die Patienten beeinträchtigen können. Eine solche Krankheit ist das Bardet-Biedl Syndrom, abgekürzt BBS. Betroffene Patienten leiden oft unter Blind- oder Taubheit, klagen über Nierenversagen oder sind krankhaft übergewichtig. Mittlerweile ist bekannt, dass die Krankheit durch Veränderungen einer Gruppe von Proteinen, BBS1 bis BBS19, zustande kommt. Diese Proteine bilden in der gesunden Zelle eine Art Shuttle - das BBSome. Dieses transportiert neue Proteinbausteine zu den Zilien. Ist dieser Transport unterbrochen, sind die Zilien nicht mehr funktionsfähig. Wie der Transport der Fracht hin zu den Zilien im Detail funktioniert, haben Forscher um Esben Lorentzen am MPI für Biochemie nun ergründet.
In der aktuellen Studie fanden die Forscher heraus, dass zwei bestimmte Proteine miteinander wechselwirken, um die neuen Bausteine sicher zu den Zilien zu bringen. Hat das BBSome-Shuttle seine Fracht im Inneren der Zelle aufgenommen, braucht es eine Art Lotsen, der es zur Oberfläche der Zelle bringt - dorthin, wo die Zilien sitzen. Dieser Lotse ist das Molekül ARL6. Es bindet an einer bestimmten Stelle an das BBSome, am Protein BBS1, und geleitet es in Richtung Oberfläche. Nach den Erkenntnissen der Forscher ist dieser Mechanismus vom Mensch bis hin zur Grünalge in seinem Grundprinzip identisch. In der Regel ein verlässlicher Hinweis, dass eine Eigenschaft elementar wichtig für das Überleben ist.
Ein molekulares Shuttle auf Abwegen
Wie entscheidend dieser Mechanismus für die Gesundheit des Menschen ist, erläutert Lorentzen an einem Beispiel: „Interessanter Weise zeigen etwa 30 Prozent aller BBS Patienten eine bisher unverstandene Mutation an einer bestimmten Stelle von BBS1. Wir konnten zeigen, dass diese Veränderung die Bindestelle zwischen ARL6 und BBS1 betrifft und dazu führt, dass die beiden Moleküle nicht mehr miteinander interagieren.“ Die Forscher vermuten, dass in diesem Fall das BBSome seinen Lotsen nicht mehr finden könne und den Zilien dadurch wichtige Bausteine fehlen. In der Folge verlieren die Zilien ihre Funktion. Künftig wollen die Wissenschaftler klären, ob weitere Proteine an dem Prozess beteiligt sind und welche Rolle sie dabei spielen. [HS]




