Neue Methode revolutioniert Krebsdiagnose
Ein deutsch-dänisches Forscherteam hat die wegweisende „Deep Visual Proteomics“-Technologie entwickelt. Sie bietet zellspezifische, protein-basierte Informationen und hilft Krebserkrankungen zu analysieren.
Wie entstehen Krebserkrankungen? Wie verändert die zelluläre Zusammensetzung eines Tumors dessen maligne Eigenschaften? Diese Fragen sind essentiell und schwer zu beantworten. Dennoch sind sie entscheidend, um Krebserkrankungen zu verstehen und um eine dauerhafte Heilung zu finden. Ein deutsch-dänisches Team unter der Leitung von Professor Matthias Mann hat nun eine wegweisende Technologie entwickelt, „Deep Visual Proteomics“. Diese Technologie stellt Forschenden und Klinikern Protein-basierte Informationen zur Verfügung und hilft Krebserkrankungen, unter Auflösung einzelner Zelltypen, zu verstehen. Die Technologie ist in der Fachzeitschrift Nature Biotechnology beschrieben und demonstriert ihr Potenzial in einer erstmaligen Anwendung auf Krebszellen.
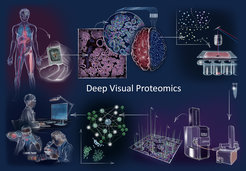
Im Uhrzeigersinn: Deep Visual Proteomics (DVP) kombiniert hochauflösende Bildgebung, künstliche Intelligenz (KI) gestützte Bildanalyse zur Klassifizierung und Isolierung von Einzelzellen mit einem neuartigen hochempfindlichen Proteomik-Workflow. DVP verbindet die datenintensive Bildgebung von Zellkulturen oder archivierten Biobankgeweben von Patienten mit einer auf Deep Learning basierenden Zellsegmentierung und einer auf maschinellem Lernen basierenden Identifizierung von Zelltypen und -zuständen. (Un)überwachte KI-klassifizierte zelluläre oder subzelluläre Objekte von Interesse werden einer automatisierten Laser-Mikrodissektion und einer massenspektrometriebasierten Proteomik-Profilierung unterzogen. Die anschließende bioinformatische Datenanalyse ermöglicht das Erfassen von Proteinsignaturen, die molekulare Einblicke in die Proteomvariationen bei Gesundheits- und Krankheitszuständen auf der Ebene der einzelnen Zellen liefern.
Proteine sind die wichtigsten Puzzlestücke für eine Vielzahl von Krankheiten. Sie werden auch als die „molekularen Arbeitspferde der Zelle“ bezeichnet. Ihre korrekte Funktion entscheidet über die Funktionsfähigkeit einer Zelle und damit auch über die eines Individuums.
Matthias Mann erklärt: „Wenn etwas in unseren Zellen nicht richtig funktioniert und wir krank werden, kann man sich sicher sein, dass Proteine auf unterschiedlichste Weise beteiligt sind. Aus diesem Grund kann die Kartierung der Proteinlandschaft uns dabei helfen folgendes herauszufinden: Warum konnte sich ein Tumor in einem bestimmten Patienten entwickeln? Welche Schwachpunkte hat dieser Tumor und welche Behandlungsmethode ist vorteilhaft?”
Angeregt durch diese Fragen hat ein fachübergreifendes Forschungsteam, unter der Leitung von Matthias Mann am Max-Planck-Institut (MPI) für Biochemie bei München und am Zentrum für Proteinforschung (CPR) der Novo Nordisk Stiftung, an der Universität von Kopenhagen in Dänemark, eine innovative neue Methode entwickelt. In der Studie werden visuelle Merkmale eines Tumors mit einer Deep-Profiling-Technik bestimmt, um Proteine in abnormen Zellgruppen zu analysieren, die an die umgebenden gesunden Zellen angrenzen. Diese Herangehensweise kann Forschern einen noch nie dagewesenen Einblick in Krebserkrankungen geben und Onkologen darin unterstützen, gezielte Strategien für die Diagnose und Therapie zu erstellen.
Deep Visual Proteomics vereint vier Technologien
„Deep Visual Proteomics” integriert zum ersten Mal die Vorteile vier verschiedener Technologien in einer einzigen Methodik. Erstens, moderne Mikroskopie erstellt hochauflösende Gewebekarten. Zweitens, maschinelles Lernen und Algorithmen künstlicher Intelligenz werden verwendet, um Zellen hinsichtlich ihrer Form, Größe oder Protein-Lokalisierung zu klassifizieren, bevor einzelne Zellen mittels hoch akkurater Laser-Mikrodissektion gesammelt werden. Drittens, nach dem Sortieren normaler oder verschiedener, erkrankter Zellgruppen, werden tausende von Proteinen innerhalb dieser Zellpopulationen gleichzeitig mittels ultra-sensitiver Massenspektrometrie bestimmt. Viertens, anspruchsvolle bioinformatische Analysen erzeugen Proteinkarten, die eine räumliche Auflösung von Proteinen bei hochkomplexen Krankheiten wie Krebs ermöglichen. Derartige Proteinlandkarten sind für Kliniker wertvolle Hilfsmittel, um die Mechanismen von Gesundheit und Krankheit besser zu verstehen.
„Unser neues Konzept ‚Deep Visual Proteomics‘, könnte ein Paradigmenwechsel für die molekulare Pathologie in der Klinik werden. Mit dieser Methode nehmen wir eine Gewebeprobe mit Tumorzellen und können innerhalb kürzester Zeit und mit geringem Aufwand tausende Proteine identifizieren. Diese Proteomanalysen enthüllen Mechanismen, welche die Tumorentwicklung antreiben. Somit können aus einem einzigen Gewebeschnitt einer Patienten-Biopsie direkt neue therapeutische Ziele abgeleitet werden. Es zeigt einen Kosmos an Molekülen innerhalb dieser Krebszellen auf”, sagt Andreas Mund außerordentlicher Professor am CPR und Teil des Teams um Matthias Mann, der diese Entwicklung bei CPR und MPI für Biochemie vorangetrieben habt.
Relevanz für die klinische Pathologie
In der Studie konnten die Forschenden „Deep Visual Proteomics” auf Zellen von Patienten mit Speicheldrüsen- und Hautkrebs anwenden. Lise Mette Rahbek Gjerdrum, Fachberaterin und außerordentliche Professorin für klinische Forschung der Abteilung für Pathologie am Seeland Universitätskrankenhaus in Roskilde und der Abteilung für klinische Medizin an der Universität Kopenhagen beschreibt: „Diese einzigartige Methode kombiniert die Analyse der Gewebearchitektur mit der Analyse des Proteoms, die für die ausgewählten Zellen spezifisch sind. Wir konnten kürzlich einen klinisch hochkomplexen Fall mit Hilfe der ‚Deep Visual Proteomics‘-Analyse diagnostizieren.“
Dr. Fabian Coscia, einer der beiden Erstautoren der Studie und seit Juni 2021 Leiter der Forschungsgruppe „Spatial Proteomics" am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft in Berlin sagt: „Die Technik kann auch für die Charakterisierung anderer Tumorarten in ähnlicher Weise angewendet werden." Sein Ziel ist es, mit Hilfe der archivierten Daten der Biobanken neue Angriffspunkte für individuelle Krebstherapien offen zu legen und dadurch auf die Patient:innen zugeschnittene Therapieformen zu entwickeln − auch für bisher therapieresistente Tumore.
Es sind nicht nur Krebserkrankungen, die mittels „Deep Visual Proteomics” besser verstanden werden können. Die Methodik kann auch auf andere Krankheiten angewendet werden. „Man kann beispielsweise die Proteine einer Nervenzelle analysieren, um herauszufinden, was genau in einer Zelle im Verlauf von neurodegenerativen Erkrankungen wie Alzheimer oder Parkinson passiert", so Coscia weiter.
„Durch die Kombination von Mikroskopie, künstlicher Intelligenz und hochempfindlicher, massenspektrometrie-basierter Proteomik, haben wir eine sehr leistungsfähige Methode entwickelt, um die molekulare Verschaltung von gesunden und kranken Zellen zu verstehen. Das könnte Ärzt:innen dabei helfen, Ziele für zukünftige Medikamente und Diagnosen zu identifizieren’’, schließt Matthias Mann ab.












