Das besondere Chaperonin der Bakteriophage EL
Forscher für Proteinhaltungshelfer am Max-Planck-Institut für Biochemie haben jetzt die molekulare Struktur des EL-Phagen-Chaperonins entschlüsselt und Besonderheiten entdeckt.
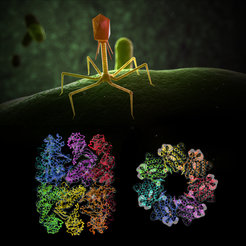
Strukturmodel des Proteinfaltungshelfer (unten), des sogenannten Chaperonin, der Bakteriophage EL (oben) in Seitenansicht und in Draufsicht.
Normalerweise tragen Viren nur eine Minimalausstattung an Erbinformation in sich. Sie schleusen diese in eine Wirtszelle ein und nutzen dort den Stoffwechsel und die Maschinerie der Proteinherstellung um sich zu vermehren. Die Bakteriophage EL trägt zusätzlich die Erbinformation eines Proteinfaltungshelfers, eines sogenannten Chaperonin, in sich. Der Bakteriophage EL ist ein Virus das einen der bekanntesten Krankenhauskeime befallen kann - das Bakterium Pseudomonas aeruginosa. Forscher um Manajit Hayer-Hartl und Experten für Proteinhaltungshelfer am Max-Planck-Institut für Biochemie haben jetzt die molekulare Struktur des EL-Phagen-Chaperonins entschlüsselt und Besonderheiten entdeckt. Die Ergebnisse der Kristall- und Kryo-Elektronemmikroskopie-Strukturen zeigen Komplexe mit 7 oder 14 Untereinheiten, die Einzel- und Doppelringe bilden. „Im Gegensatz zu den bekannten Chaperoninen sind alle gefundenen Strukturen offen, bilden also keinen Faltungskäfig wie bei GroEL/GroES.“, so Andreas Bracher, Erstautor der Studie. „Möglicherweise repräsentiert dieses Phagen-Chaperonin einen primitiven, evolutionären Vorläufer der heutigen, zellulären Chaperonine, welcher ohne Einkapselung der Substratproteine arbeitet.“ Die Studie wurde im Fachmagazin PLOS ONE veröffentlicht.
Originalpublikation:
A. Bracher, SS Paul, H. Wang, N. Wischnewski, F. Ulrich Hartl, M. Hayer-Hartl:
"Structure and conformational cycle of a bacteriophage-encoded chaperonin"
PLOS ONE, April 2020
DOI: https://doi.org/10.1101/2020.02.24.962803
