F.-Ulrich Hartl
Forschungsabteilung Zelluläre Biochemie
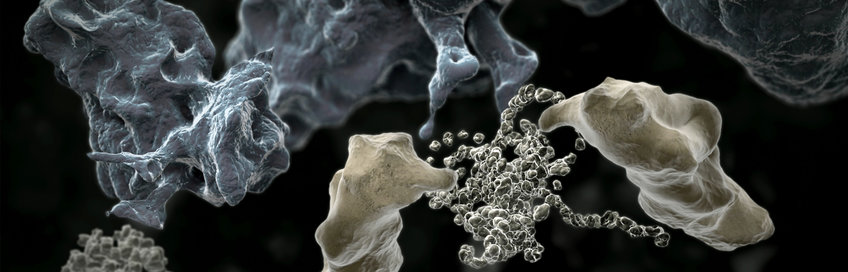
Die meisten Proteine haben komplexe molekulare Strukturen, die sich nicht effizient von selbst durch Proteinfaltung ausbilden. Helferproteine, die „Zelluläre Anstandsdamen“ oder molekulare Chaperone genannt werden, sorgen dafür, dass diese Proteine sich in ihre korrekte Form falten und nicht zu nutzlosen (oder sogar toxischen) Aggregaten verklumpen. Die molekularen Chaperone spielen daher eine wichtige Rolle bei der Aufrechterhaltung der Proteinfunktion in Zellen, der sogenannten Protein Homöostase. Die Wissenschaftler in der Forschungsabteilung „Zelluläre Biochemie“ von F.-Ulrich Hartl erforschen, wie die molekularen Chaperone aufgebaut sind und wie sie funktionieren. Die Funktionsweise einer wichtigen Familie von molekularen Chaperonen, den sogenannten Chaperoninen, konnten sie bereits im Detail aufklären. Diese bilden fassförmige Strukturen, die ungefaltete Proteine einkapseln können, wodurch diese ungestört falten und die Bildung von Aggregaten vermieden wird. Die Forschungsabteilung untersucht weiterhin, wie toxische Proteinaggregate, die bei neurodegenerativen Erkrankungen wie Alzheimer, Parkinson und Chorea Huntington mit zunehmenden Alter vermehrt auftreten, die Zellfunktionen beeinträchtigen und sucht nach Strategien, wie dies verhindert werden kann.

