Anatomie eines Fadenwurms - Molekül für Molekül
Eine neue Dimension der Kryoelektronentomographie. Forschende um Jürgen Plitzko am MPI für Biochemie ermöglichen dank verbesserter Arbeitsschritte die anatomische Darstellung von Vielzellern mit molekularer Auflösung.
Forschenden um Jürgen Plitzko am Max-Planck-Institut (MPI) für Biochemie ist es gelungen, den ersten Arbeitsschritt des Forschungsalltages vieler Wissenschaftler*innen in der Kryo-Elektronentomographie (Kryo-ET) entscheidend zu vereinfachen. Durch ihre neu entwickelte Methode ist es nun erstmals möglich, eine Serie von Schnitten aus dem Modellorganismus C. elegans zu erhalten und mittels Kryo-ET abzubilden. Dadurch öffnen sie das Tor zur anatomischen Untersuchung vielzelliger Lebewesen und Gewebeproben mit molekularer Auflösung. Die Ergebnisse wurden in der Fachzeitschrift Nature Methods veröffentlicht.
Das Studium der menschlichen Anatomie in gesundem und krankem Zustand ist ein entscheidender Bestandteil der modernen Medizin. Doch die Untersuchung der Anatomie einzelner Zellen auf molekularer Ebene benötigt komplexe bildgebende Methoden mit einer sehr hohen Auflösung.
Die Kryo-Elektronentomographie (Kryo-ET) ist eine Methode, die es erlaubt die innere Struktur von Zellen bis hin zu einzelnen Proteinen abzubilden. Ähnlich wie in der Computertomographie (CT), mit der der menschliche Körper untersucht werden kann, wird auch bei der Kryo-ET eine Probe aus verschiedenen Richtungen durchleuchtet. Die daraus resultierenden Bildinformation können dann dazu genutzt werden, eine dreidimensionale Nachbildung des untersuchten Objektes zu erhalten. Im Gegensatz zur CT, bei der Menschen sich einfach in eine Maschine legen können, ist bei der Kryo-ET eine aufwändige Vorbereitung der Probe nötig, die die Qualität der erhaltenen Daten entscheidend beeinflusst.
Die verwendeten Proben müssen extrem dünn sein. Selbst eine einzige menschliche Zelle ist noch zu dick und muss für diese Methode zunächst zu einer dünnen Scheibe weiterverarbeitet werden, die Lamelle genannt wird. Diese Lamelle ist dann nur noch knapp ein vierhundertstel eines menschlichen Haares dick. Doch bevor die Probe ausgedünnt werden kann, muss sie zunächst konserviert werden, indem sie sozusagen ‚schockgefroren‘ wird. Bei dieser speziellen Art des Einfrierens, die Vitrifizierung genannt wird, wird die Probe so schnell eingefroren, dass sich keine Eiskristalle bilden. Diese würden die empfindlichen Strukturen im Inneren der Probe zerstören.
„Durch den technologischen Fortschritt der vergangenen Jahre ist es bereits jetzt möglich, kleine Strukturen in einzelnen menschlichen Zellen darzustellen. Doch für kleine Vielzeller oder ganze Gewebe waren solche Untersuchungen bisher kaum möglich.“, erklärt Christoph Kaiser, Co-Erstautor der Studie.
Nun ist es den Forschenden gelungen, die bisher extrem aufwändige Probenvorbereitung so zu optimieren, dass sie effizienter und mit einer höheren Erfolgsrate durchgeführt werden kann. Zusätzlich liefert sie nun nicht mehr nur eine, sondern gleich mehrere Lamellen aus einer Probe. Hierzu haben die Wissenschaftler*innen frisch geschlüpfte Larven des Fadenwurms C. elegans vitrifiziert und eine ganze Larve in einem quaderförmigen Eisblock ausgeschnitten. Anschließend wurde dieser Block immer wieder an einem Probenträger befestigt und Scheibe um Scheibe abgeschnitten. Insgesamt gelang es den Forschenden so, 32 Schnitte von diesem Individuum zu erhalten. Die Vorgehensweise ist in der Illustration verdeutlicht.

„Ich denke das Bemerkenswerteste an unserer neuen Methode ist, dass wir viel weniger biologisches Material verwerfen müssen als zuvor. Bisher konnten wir pro Organismus oder Zelle nur einen, oder sehr wenige, Schnitte untersuchen und der Rest musste verworfen werden. Dadurch erhalten wir mehr anatomisch zusammenhängende Informationen, während die molekularen Details bewahrt bleiben.“, so Oda Schiøtz, Co-Erstautorin der Studie.
Um das enorme Potential ihrer neu entwickelten Methode zu verdeutlichen, zeigen die Forschenden hochaufgelöste Aufnahmen verschiedener anatomischer Strukturen, wie Muskeln, Nerven und Darm, in ihrem nahezu natürlichen Zustand und physiologischen Kontext. Darüber hinaus konnten sie aus diesen Daten die Struktur zweier wichtiger zellulärer Proteinkomplexe rekonstruieren: das Ribosom, die zelluläre Maschine der Proteinherstellung, und Mikrotubuli, die eine wichtige Komponente des zellulären Skeletts sind und unsere Zellen stabilisieren.
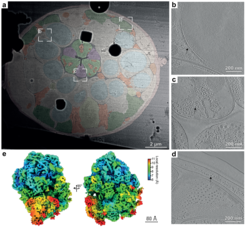
„Unsere neue Methode gewährt einen bahnbrechenden Einblick in den molekularen Aufbau großer Zellen, kleiner Organismen, oder ganzer Gewebeproben. Unser nächstes Ziel wird es sein, diese Methode noch schneller zu machen und sie auf vielfältige biologische Proben anzuwenden.", sagt Sven Klumpe, co-korrespondierender Autor der Studie. Jürgen Plitzko, Leiter der Forschungsgruppe CryoEM Technologie und co-korrespondierender Autor der Studie, fügt hinzu: „So kann die Methode einerseits dabei helfen, grundlegende biologische Fragen in der Zell- und Gewebebiologie zu beantworten, andererseits verschafft sie uns aber auch genauere Einblicke in die molekularen Prozesse bei Krankheiten, die beispielsweise durch Virus- und Bakterieninfektionen ausgelöst werden.“
[tb]
Wörterbuch der Forschungsgruppe Cryo-EM Technologien:
Vitrifizierung: Die Vitrifizierung beschreibt einen Vorgang, bei dem Wasser extrem schnell in nur wenigen Millisekunden eingefroren wird. So kann im besten Fall die Bildung von Eiskristallen vollständig verhindert werden.
Kryo-Elektronentomographie (Kryo-ET): Während der Kryo-Elektronentomographie werden zweidimensionale Bilder aus verschiedenen Winkeln mit einem speziellen Mikroskop (Transmissionselektronenmikroskop) aufgenommen. Diese Methode muss bei einer Temperatur von unter -160°C durchgeführt werden und benötigt extrem dünne Proben. Aus den Bildern kann dann die 3D-Struktur der Probe nachgebildet werden.
Lamelle: Da für die Kryo-Elektronentomographie extrem dünne Proben benötigt werden, müssen die Gewebe oder Zellen die untersucht werden sollen zunächst ausgedünnt werden. Übrig bleiben dann die sogenannten Lamellen, die für die Kryo-ET verwendet werden können.
Ribosom: Ribosomen sind Komplexe die aus Proteinen und RNA bestehen. In unseren Zellen sind sie dafür zuständig Proteine herzustellen.
Mikrotubuli: Mikrotubuli sind röhrenförmige Proteinkomplexe die für die Stabilität der Zelle verantwortlich sind. Zusammen mit anderen Proteinen sind sie beispielsweise aber auch an Transportprozessen, wie der Aufteilung der Erbinformation während der Zellteilung beteiligt.


