Flügel Kommandant: Ein Muskelgen ermöglicht Insekten das Fliegen
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für Biochemie
Insektenflug und Flugmuskeln
Die ersten Insekten sind vor 400 Millionen Jahren entstanden und haben sich im Verlauf der Evolution mit vielen Hunderttausend verschiedenen Spezies zur artenreichsten Klasse aller heute auf der Erde lebenden Tiere entwickelt. Die meisten besitzen Flügel und sind eindrucksvoll gute Flieger, was maßgeblich zu ihrer zahlenmäßigen Dominanz und Artenvielfalt beigetragen haben könnte. Die Körpergröße der meisten heute lebenden Insekten ist jedoch relativ gering, entsprechend sind ihre Flügel oft nur wenige Millimeter groß, in manchen Fällen sogar noch kleiner. Wie können solch winzige Flügel den nötigen Auftrieb erzeugen, um den Insektenkörper in die Luft zu befördern und ihn mit mehreren Metern pro Sekunde in die gewünschte Richtung zu bewegen? Das Geheimnis liegt in den Flugmuskeln der Insekten. Die meisten Insekten besitzen extrem schnell schlagende Flugmuskeln, die bis zu tausend Mal pro Sekunde kontrahieren können und dadurch die schnellen Oszillationen der Flügel antreiben (Abb. 1).
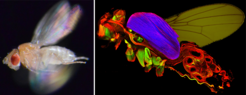
Im Gegensatz zu den Körpermuskeln von Säugetieren und den normalen Körpermuskeln der Insekten, beispielsweise der Beinmuskulatur, die synchron von den ankommenden Nervenimpulsen zur Kontraktion stimuliert werden, reagieren die schnellen Flugmuskeln asynchron. Das bedeutet, jedes einzelne Nervensignal löst eine Serie von Flugmuskelkontraktionen aus. Dies wird durch die paarige Anordnung der Flugmuskeln ermöglicht; eine Muskeleinheit kontrahiert und zieht die Flügel nach unten, gleichzeitig dehnt sie indirekt die zweite Muskeleinheit. Dieser mechanische Zug löst die Kontraktion der zweiten Einheit aus, was den Flügel wieder nach oben zieht und wiederum die erste Muskeleinheit dehnt und so zur Kontraktion antreibt. Mit Hilfe dieser mechanisch ausgelösten Stimulation erreicht das Insekt eine sehr hohe Flügelschlagfrequenz, und der Insektenkörper inklusive der Flügel vibriert wie bei einem Oszillator.
Der durch mechanischen Zug ausgelöste Kontraktionsmechanismus der Flugmuskeln hat einen besonderen Aufbau ihres Kontraktionsapparats zur Folge. Flugmuskeln besitzen eine fibrilläre Struktur mit großen, deutlich voneinander abgetrennten Myofibrillen, die die kontraktilen Einheiten beinhalten. Im Gegensatz dazu ist alle übrige Muskulatur, wie zum Beispiel in den Beinen, quergestreift und zeigt einen röhrenartigen Aufbau (Abb. 2).

Systematische Suche nach Flugmuskelgenen
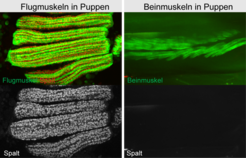
Um die Entwicklung der oszillierenden, asynchronen Flugmuskeln und ihrer besonderen Struktur zu verstehen, haben die Forscher in jahrelanger Arbeit gezielt nahezu jedes Gen der Taufliege (Drosophila melanogaster) in den Muskeln ausgeschaltet und dann die Fliegen auf ihre Flugfähigkeit geprüft. Nach Testen von über 10000 Genen in rund 25000 Flugtests war es fast geschafft: Etwa 300 Gene waren identifiziert, die für die Funktion der Flugmuskeln wichtig sind [1]. Mittels detaillierter histologischer Analyse der Flugmuskeln der flugunfähigen Tiere wurde der entscheidende Schalter für die Flugmuskelbildung identifiziert. Ein Drosophila Stamm, in dem das Gen spalt ausgeschaltet ist, hat den fibrillären Aufbau seiner Flugmuskeln vollständig verloren und bildet stattdessen quergestreifte Muskeln mit einem röhrenartigen Aufbau, charakteristisch für die Beinmuskulatur, aus (Abb. 2). Diese Muskeln können nicht mehr durch mechanischen Zug zur Kontraktion angeregt werden; deshalb sind die Tiere fluglos. Das bedeutet, spalt ist für die Entwicklung der asynchronen, fibrillären Flugmuskeln unabdingbar [2].
Das Schaltergen spalt steuert die Flugmuskelentwicklung in Insekten
Das von spalt kodierte Protein ist ein Transkriptionsfaktor. Transkriptionsfaktoren befinden sich im Zellkern und binden dort an die DNA, also die Erbinformation. Sie agieren als molekulare Schalter, die entscheiden, welche Teile der in allen Zellen vorhandenen DNA abgelesen und somit in Proteine übersetzt werden. Dieser Vorgang ist das A und O für die Entwicklung aller Zellen und Organe, da immer die richtigen Proteinkombinationen vorhanden sein müssen, um einen bestimmten Zelltyp bilden zu können. Flugmuskeln bilden sich während der Metamorphose von Drosophila im Puppenstadium aus. In diesem Stadium befindet sich das Spalt-Protein nur in den Zellkernen der sich bildenden Flugmuskeln, jedoch nicht in den sich bildenden Beinmuskeln (Abb. 3). Erstaunlicherweise kann Spalt sogar Beinmuskulatur in flugmuskelartige, fibrilläre Muskulatur umprogrammieren, wenn es experimentell in die sich entwickelnden Beinmuskeln eingebracht wird. Das zeigt, dass Spalt als molekularer Schalter wirkt, dessen Aktivität in Zellkernen ausreichend ist, um fibrilläre Flugmuskulatur zu erzeugen.
Die Aktivität von Spalt verändert die Bildung einer ganzen Reihe von Muskelproteinen, die wiederum selbst eine Veränderung der Flugmuskelmorphologie und deren Kontraktionseigenschaften zur Folge haben. Das bedeutet, Spalt kontrolliert die Flugmuskelbildung zu einem frühen Zeitpunkt und schaltet so alle untergeordneten Proteine ein, die dann das Programm weiterführen, einen funktionierenden fibrillären Flugmuskel zu bilden, dessen schnelle Kontraktionen durch mechanischen Zug ausgelöst werden können [2].
Die Funktion von Spalt ist nicht beschränkt auf Drosophila. Experimente mit Wespen und Käfern zeigen, dass die fibrilläre Morphologie der Flugmuskeln sowie die Funktion von Spalt in den meisten Insektenarten schon seit rund 300 Millionen Jahren evolutionär konserviert und damit für die Flugfähigkeit der meisten Insekten verantwortlich ist: Wird Spalt in Käfern ausgeschaltet, verlieren auch deren Flugmuskeln die charakteristische, fibrilläre Morphologie und werden zu Beinmuskeln umprogrammiert.
Interessanterweise haben Säugetiere, also auch der Mensch, vier Spalt ähnliche Gene. Auch wenn deren Funktion noch nicht genau studiert ist, so ist bekannt, dass drei von ihnen im Herzen gebildet werden. Da das Säugetierherz eine gewisse Ähnlichkeit zum Flugmuskel der Insekten besitzt - seine Kontraktion wird auch mechanisch, und zwar ebenfalls auf Zug, beeinflusst -, spekulieren die Forscher über eine mögliche Funktion von Spalt im Herzen des Menschen.
Ausblick
Der Aufbau eines funktionieren Muskels muss während der Entwicklung sehr genau gesteuert werden. Die Wissenschaftler wollen zukünftig besser verstehen, wie ein einziger Faktor, nämlich Spalt, eine ganze Kaskade von Genen anwerfen kann, sodass am Ende ein funktionierender Flugmuskel entsteht. Dazu werden modernste Methoden der Mikroskopie angewandt, um die Muskelbildung in der lebenden Puppe zu verfolgen. Zusätzlich sollen die verschiedenen Stadien der Muskelbildung mithilfe neuer Hochdurchsatzverfahren genauestens analysiert werden. Anhand der Ergebnisse soll der Mechanismus verstanden werden, wie ein komplexes Organ, der Flugmuskel, in jedem Individuum reproduzierbar gebildet wird.


