Max-Planck-Forscher entdecken neuen Mechanismus für die Stilllegung von Genen
Gene werden je nach Bedarf einer Zelle ‚ein-‘ oder ‚aus-‘ geschaltet. Der Mechanismus, wie genau diese einzelnen Schalter in einer bestimmten Zelle betätigt werden, ist immer noch weitgehend unbekannt. Forscher am Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München konnten jetzt einen weiteren Aspekt beifügen: „Unsere Ergebnisse zeigen eine unerwartete Verknüpfung von verschiedenen regulatorischen Bausteinen, die erklärt wie Gene in einer Zelle permanent stillgelegt werden können“, sagt Jürg Müller, Forschungsgruppenleiter am MPIB. Die Ergebnisse wurden jetzt in der Fachzeitschrift Nature Structural & Molecular Biology veröffentlicht.
Wie ein Ei dem anderen gleicht sich die DNA aller Zellen im Körper des Menschen. Deren Form und Funktion gleichen sich jedoch ganz und gar nicht. So haben beispielsweise Zellen in der Haut ganz andere Eigenschaften und Fähigkeiten als Zellen des Gehirns. Das liegt daran, dass nur bestimmte Bereiche des Erbguts, die Gene, entweder ‚ein‘ oder eben ‚aus‘ geschaltet werden. Wie die Zellen die Schalter allerdings bedienen, ist bis heute nicht vollends aufgeklärt.
Bekannt ist allerdings, dass Veränderungen an der Verpackung der DNA, den sogenannten Histon-Proteinen, dabei eine Rolle spielen. Zu verstehen, wie diese Veränderungen im Detail funktionieren - dieser Herausforderung stellen sich Jürg Müller und sein Team am MPIB.
Eine unerwartete Funktion einer seit langem bekannten Proteinmodifikation
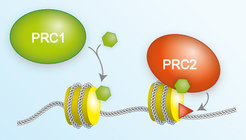
Bei ihren Untersuchungen konzentrierten sich die Forscher auf eine Histon-Modifikation, die zwar seit über 30 Jahren bekannt ist, deren biologische Funktion aber weitestgehend ungeklärt blieb. In ihrer aktuellen Studie konnten die Wissenschaftler zeigen, dass an diese Histon-Modifikation (H2A Mono-Ubiquitinierung) durch den PRC1 Komplex aus der sogenannten Polycomb-Familie, PRC2, ein anderer Polycomb Komplex, bindet. PRC2 selbst modifiziert ein anderes Histon, das wiederum als Markierung für die Bindung von PRC1 funktioniert. Gemeinsam bilden diese beiden Komplexe somit einen Rückkopplungs-Mechanismus, der dafür sorgt, dass Polycomb-regulierte Gene stillgelegt werden.
„Der nächste Schritt wird nun sein, die Rolle dieses Rückkopplungs-Mechanismus in der Fliege zu analysieren und so zu verstehen, wie Gene permanent stillgelegt werden“, sagt Reinhard Kalb, Wissenschaftler am MPIB.
[HS]
Originalpublikation:
R. Kalb, S. Latwiel, H. I. Baymaz, P. W. Jansen, C. W. Müller, M. Vermeulen and J. Müller: Histone H2A monoubiquitination promotes histone H3 methylation in Polycomb repression. NSMB, May 18, 2014.
DOI:10.1038/nsmb.2833






