Molekulare Systembiologie halophiler Archaeen
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für Biochemie
Halophile Archaeen und ihre Überlebensstrategie
Lebensformen in Salzseen und Lagunen wurden bereits von Charles Darwin auf seiner Südamerikareise beobachtet und notiert. Aber erst Anfang des letzten Jahrhunderts wurden Mikroorganismen von getrocknetem Salzfisch, gegerbten (eingesalzenen) Fellen und schließlich aus allen Biotopen, in denen sich Salz bis zur Sättigung anreichert, isoliert und genauer untersucht. Diese Prokaryoten kommen in riesiger Menge in Salzseen oder Salzgewinnungsanlagen am Meer vor und verursachen bei starkem Wachstum durch ihre Carotinoidfarbstoffe eine orange bis dunkelrote Verfärbung der Gewässer (Abb. 1).
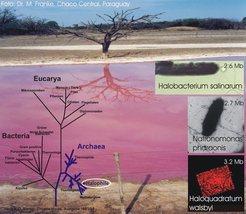
Auf einem Zweig dieser Prokaryoten, den extrem halophilen Archaeen, finden sich Organismen, die in gesättigten Salzlösungen nicht nur wachsen, sondern auch im Inneren von Salzkristallen über 200 Millionen Jahre lang lebensfähig erhalten bleiben. Um bei so hoher Ionenstärke den osmotischen Druck auszugleichen, evolvierten in der Natur zwei Strategien. Halophile Bakterien nutzen „kompatible Osmolyte”, die auch bei Konzentrationen um 5 M den Stoffwechsel der Zelle nicht stören. Halophile Archaeen dagegen, wie zum Beispiel Halobacterium salinarum, gleichen den osmotischen Druck durch Aufnahme von Salz, bevorzugt Kaliumchlorid, ins Innere aus. Dies führt aber zu neuen Herausforderungen, beispielsweise die Löslichkeit von Proteinen in der Zelle unter diesen Bedingungen zu gewährleisten, womit sich die Frage nach den Eigenschaften von Wasser in einer Lösung mit etwa 500 g Protein und 300 g Salz pro Liter Flüssigkeit stellt. In der Tat entdeckten wir kürzlich „langsames Wasser” in einem halophilen Archaeon. Die Moleküle dieser neuen Form des Wassers bewegen sich etwa 250 mal langsamer durch das Zellinnere und machen fast 75 % des zellulären Wassers aus [1]. Dies weist auf eine neuartige Organisation aller beteiligten Moleküle in solchen Flüssigkeiten hin.
Über die Gemeinsamkeit sättigender Salzkonzentrationen hinaus stellen noch andere Besonderheiten der Biotope weitere Anforderungen an halophile Archaeen. Salzseen können zusätzlich hohe Konzentrationen an Natriumcarbonat oder Magnesiumsalzen enthalten und weitere physiologische Anpassungen von Organismen erfordern, die beispielsweise bei Natronomonas pharaonis oder Haloquadratum walsbyi vorliegen.

Für alle drei Organismen erhielten wir die Genominformation durch Sequenzierung der etwa drei Megabasen langen DNA und konnten so einige der ungewöhnlichen Eigenschaften von N. pharaonis und Hq. walsbyi zu Tage fördern [2]. N. pharaonis (Abb. 2, schematische Darstellung), das bis zu pH 12 überlebt, löst das Problem der drohenden alkalischen Extraktion extrazellulärer peripherer Membranproteine durch alkaliresistente Lipidanker. Dem bei hohem pH auftretenden Ammoniak- und Schwermetallmangel wird durch eine spezifische Genausstattung begegnet. Weiterhin besteht die Zellwand aus einer Vielzahl glykosilierter Zelloberflächenproteine, die in der Zellmembran verankert sind und für eine schützende Wasserhülle sorgen (Abb. 2). Diese Eigenschaft, mithilfe von Zuckerresten, welche zudem oft durch Sulfatierung negativ geladen sind, viel Wasser auf der Oberfläche zu binden, ist für alle halophilen Archaeen charakteristisch.
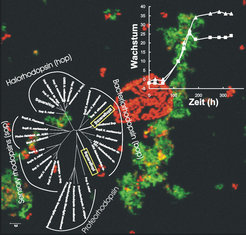
Haloquadratum walsbyi wurde vor 26 Jahren entdeckt, konnte aber erst vor kurzem in Kultur genommen werden (Abb. 3). In der Natur ist dieser Organismus in salzhaltigen Biotopen der am weitesten verbreitete Überlebenskünstler, der bei gesättigter Kochsalzkonzentration auch noch zusätzlich bis zu 2 M Magnesiumsalze verträgt. Eine weitere Erhöhung führt zu seinem Absterben und zur Sterilität des Biotops. Unter den Lebensbedingungen von Haloquadratum ist die Aktivität des Wassers sehr klein und das Phosphatangebot extrem gering. Letzterem begegnet der Organismus, indem er organische Phosphonate aufnimmt, die nach Spaltung das intrazellulär benötigte Phosphat liefern. Zudem ersetzen die Zellen einen Großteil ihrer Phospholipide durch Sulfolipide. Die geringe Wasseraktivität bekämpft Hq. walsbyi mit einem über 9000 Aminosäuren langen Protein, dem längsten bisher in Archaeen gefundenen, das in seinen strukturellen Eigenschaften auffallende Ähnlichkeit mit dem menschlichen Mucin hat. Halomucin kann mit spezifischen Antikörpern als eine Art Schleimhülle um die Zellen dargestellt werden (Abb. 3, grün) und scheint damit eine sehr ähnliche Rolle zu spielen wie das Mucin, das im Lungenepithel des Menschen die Zellen vor Austrocknung schützt. Warum die Zellen perfekt quadratisch sind, kann aus der Genomanalyse nicht beantwortet werden, wohl aber findet die extreme Dünne der Zellen mit 30 - 50 nm eine Erklärung. Das so maximierte Oberflächen-Volumenverhältnis und auftriebverleihende Gasvakuolen, die nur entlang der Ränder der Zelle vorkommen, geben zwei Bakteriorhodopsinen maximale Fläche und optimale Orientierung zum Licht für photosynthetisches Wachstum. Eines der beiden Bakteriorhodopsine ist archaealer Natur, während das andere ein missing link von archaealen und bakteriellen, lichtgetriebenen Protonenpumpen bildet. Die letzteren wurden erst vor wenigen Jahren entdeckt und erlauben der bakteriellen Biomasse der Ozeane offensichtlich, mithilfe von Bakteriorhodopsin („Proteorhodopsin”) einen erheblichen Beitrag zur photosynthetischen Leistung des Planktons zu liefern.
Halophile Proteine
Proteine müssen in gesättigter Kochsalzlösung eine Art Kampf um das Wasser bestehen, um löslich zu bleiben. Halophile Archaeen evolvierten Proteine mit einem extrem niedrigen isoelektrischen Punkt, der im Durchschnitt bei 4,7 liegt. Röntgenstrukturanalysen [3], aber auch die genomweite Modellierung der von Halobacterium salinarum kodierten Proteine lieferten weitere Befunde: Die Außenseite der Proteine ist dicht mit sauren und gering mit alkalischen Aminosäuren belegt. Damit halten die Carboxylgruppen, die besonders effizient Wasser binden können, die Proteine in Lösung. Halophile Proteinstrukturen zeigen auch, wie größere Proteinkomplexe, zum Beispiel das Thermosom (involviert in die Faltung von Proteinen), das Proteasom (Degradationsmaschine für nicht benötigte Proteine) oder die DNA-abhängige RNA- Polymerase ihre Innenflächen so gestalten, dass sie ihre Funktion optimal erfüllen können.
Besonders interessant ist die durch NMR-Analyse ermittelte Struktur eines cyanobakteriellen Ferredoxins aus H. salinarum. Während die Sequenzhomologie keinen Zweifel daran lässt, dass H. salinarum das cyanobakterielle Ferredoxin durch horizontalen Gentransfer gewonnen hat, zeigt seine Struktur, dass eine etwa 30 Aminosäuren lange Insertion, bestehend aus zwei α-Helices mit 50 % sauren Aminosäuren, dem Molekül seinen extrem sauren Charakter verleiht. Ohne die zusätzlichen zwei α -Helices wird dieses Protein in halophilen Archaeen nicht exprimiert beziehungsweise nicht in einen funktionellen Zustand gefaltet, während es mit dem halophilen Zusatzelement in Escherichia coli nicht im funktionellen Zustand erhalten werden kann. Eine genomweite Analyse zeigt, dass über 150 Gene dieses Insertionselement tragen, womit die Vermutung naheliegt, dass es sich um eine erste Adaptionsmaßnahme der halophilen Archaeen nach Aufnahme fremder Gene handelt [4].
Molekulare Systembiologie
Molekulare Systembiologie, heute in aller Munde, lässt sich etwa wie folgt definieren: Die Modellierung von Zellmodulen mit einem unvollständigen Satz von Daten. Das Modell (bzw. alle möglichen Modelle) muss Vorhersagekraft haben und Experimente anregen, die zur Falsifizierung (oder Verifizierung) eines Teiles der möglichen Modelle führen. In einem iterativen Prozess gelangt man so im Idealfall zu einem Modell, das auf der Basis der verfügbaren Daten das einzig mögliche ist. Der iterative Zyklus von Modellierung und Experiment setzt zwei wesentliche Dinge voraus: eine Kooperation von Biochemikern, Molekularbiologen, Physikern, Ingenieuren, Informatikern und Mathematikern und ein Datenbanksystem, das alle gewonnenen Daten effizient verwaltet. Auf diesem Gebiet bekommt deshalb die „Kaffeetassennähe” von Wissenschaftlern aus verschiedenen Disziplinen eine enorme Bedeutung.
Für die halophilen Archaeen wurde die Datenbank Halolex (www.halolex.mpg.de) geschaffen, an die weitere Teilbanken wie Pathnet, B-net, Halohigh und Halotext gekoppelt und die ihrerseits mit dem MIGENAS-system (www.migenas.org) verbunden sind. In der Summe erfasst Halolex alle experimentellen Daten halophiler Archaeen und macht die gesamte verfügbare Literatur abrufbar, die vom System Halotext spezifisch nach Genen aufbereitet wird. Ein einfaches Navigationssystem mit anschaulicher Darstellung erlaubt einen sehr raschen Wechsel von Genom- und Annotationsdaten zu experimentellen Ergebnissen aus der Proteom- und Transkriptomanalyse, wobei in mehreren Schichten bis auf die Primärdaten hin zurückgegriffen werden kann. Die größten Blöcke der Datenspeicherung betreffen die Genom-, Transkriptom- und Proteomanalyse, die Strukturmodellierung sowie die metabolen Daten der Organismen.
Der Proteomik kommt eine zentrale Rolle für die korrekte Annotation der Genome zu. Beispielsweise enthält das Genom von H. salinarum über 9000 offene Leserahmen, die Peptide mit mehr als 100 Aminosäuren kodieren, womit im Durchschnitt 2,7 der 6 möglichen Leserahmen auf dem Chromosom potenzielle Gene darstellen. Durch Genomvergleich und Homologiesuche, entscheidend aber durch die erschöpfende Proteomanalyse war es möglich, einen Satz von 2821 proteinkodierenden Genen vorauszusagen und weitgehend zu bestätigen. Weitere wesentliche Ansätze der Proteomanalyse für die systembiologische Untersuchung der Zelle sind die Analyse der N-Termini und chemischen Modifikationen (Phosphorylierung und Methylierung) der Proteine sowie deren relative Quantifizierung, um zelluläre Zustände (zum Beispiel aerobes und phototrophes Wachstum) miteinander zu vergleichen. Die absolute Quantifizierung eines individuellen Proteins erlaubt die sichere Bestimmung seiner Kopienzahl in der Zelle und ist von besonderer Bedeutung für systembiologische Ansätze.
Die Darstellung des H. salinarum Genoms durch genspezifische Sonden passt in quintuplikater Ausführung auf einen Objektträger und dient quantitativen Analysen (einschließlich der RT-PCR-Analyse) zur Erstellung von Transkriptionsnetzwerken bei Änderungen des Lebensstils der Zellen, wie etwa dem Übergang von aerobem auf phototrophes Leben. Spezifische Merkmale sind hier eine erstaunlich hohe Zahl an exprimierten Genen und die hingegen geringe quantitative Veränderung von Transkriptmengen bei drastischen Änderungen von Wachstumsbedingungen. Dies lässt die Vermutung zu, dass es zur Überlebensstrategie der Spezies gehört, in Zeiten ausreichender Ernährung die meisten zellulären Proteine als Vorrat für schlechte Zeiten anzulegen, in denen Energiemangel die Synthese von dann benötigten Enzymen behindern würde.
Metaboles Netz des Stoffwechsels
Der automatischen Zuweisung enzymatischer Aktivitäten durch Homologiesuche folgten Proteomanalyse und Experten-Validierung. Alle Daten sind zusammen mit den verfügbaren Literaturdaten in der Datenbank „Pathnet” gespeichert (Abb. 4). Ein erstes Netz des Stoffwechsels aus 308 Genen und 773 Reaktionen wurde gebildet, das über das Programm B-net abrufbar ist. Mithilfe der so genannten constraint modelling Verfahren kann aus der Netzwerkinformation, die auch Stöchiometrien der Reaktionen sowie ihre Reversibilitäten enthält, ein Modell geschaffen werden, das Vorhersagecharakter hat, zum Beispiel für die Aussage, welche der Aminosäuren H. salinarum zum Wachstum braucht beziehungsweise welche Aminosäuren das Wachstum nur zusätzlich fördern. Die in silico gemachte Voraussage stimmte mit den experimentellen Daten überein, sodass in einem zweiten Schritt die Vorhersage über Wachstumsgeschwindigkeiten, Verbrauch und Produktion der Aminosäuren auf der Basis eines quantitativen zellulären Parametermodells anschließend experimentell überprüft werden konnte. Wiederum stimmte das Modell mit den experimentellen Daten überein, die durch umfangreiche Aminosäureanalysen der Zellmasse und Verlauf der Konzentrationsänderungen im Medium während des Wachstums ermittelt wurden.
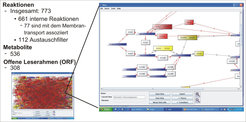
Damit ist es zum ersten Mal gelungen, durch Netzwerkanalyse metabole Flüsse der Zelle vorauszusagen, ohne zuvor Stoffflüsse innerhalb der Zelle zu messen [5]. Große Bedeutung werden diese molekularen Netzwerkmodelle von H. salinarum auch für die Biotechnologie des Bakteriorhodopsins bekommen, da mit gezielter Genveränderung Wachstums- und Produktionsraten von Bakteriorhodopsin optimiert werden können.
Eine andere Erweiterung der metabolen Netzwerke betrifft die Regulation des Stoffwechsels bei Änderung der Lebensbedingungen der Zelle. Drei Zustände wurden hier mit Transkriptom- und Proteomanalysen quantitativ verglichen: aerobes Wachstum ohne Licht, phototrophes Wachstum ohne Sauerstoff und der Wechsel von synthetischem auf ein komplexes Medium. Derzeit werden diese Daten für die Modellierung aufbereitet.
Bioenergetik
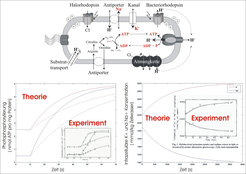
Viele halophile Archaeen besitzen ein ausgeklügeltes System zur Energiegewinnung unter drastisch verschiedenen Lebensbedingungen. H. salinarum, für das bereits in den siebziger Jahren ausführliche und quantitative Daten zur Bioenergetik und Photophysiologie gesammelt worden waren, verfügt über die normale Atmungskette, kann aber bei Fehlen von Sauerstoff Substanzen wie Dimethylsulfoxid oder Trimethylaminoxid als finale Elektronenakzeptoren verwenden. Darüber hinaus können die Zellen mithilfe von Bakteriorhodopsin nicht nur Photosynthese betreiben und auf diese Weise wachsen, sondern auch mithilfe eines an das Protonen-Translokationssystem gekoppelten Natrium-Kalium-Austauschprozesses einen riesigen Kaliumspeicher in molarem Umfang aufladen. Der so entstandene Kalium-Konzentrationsgradient ist in der Lage, über Nacht das ATP-Niveau auf mittlerem Niveau für metabole Aktivität zu halten. Diese Situation erinnert an die axonale Aktivität von Neuronen, deren Na/K-Gradienten nicht durch Licht, sondern durch ATP gebildet und aufrechterhalten werden.
Zur Modellierung des bioenergetischen Geschehens in der Zelle wurde eine Datenbank geschaffen, in der wesentliche Daten wie Volumina, elektrische Kapazitäten, Kopienzahl der beteiligten Moleküle sowie die mathematischen Funktionen für Energieumwandlungen und anderes enthalten sind. Ein so genanntes Petrinetz beschreibt die Grundoperationen dieses bioenergetischen Systems, das mithilfe von Differenzialgleichungssystemen (ODE) die experimentellen Daten bereits nachzustellen erlaubt (Abb. 5). Beabsichtigt ist, in naher Zukunft den gesamten Datensatz aus den siebziger Jahren sowie alle bekannt gewordenen Literaturdaten in dieses Modell einfließen zu lassen und seine erweiterte Funktionsfähigkeit zu beweisen.
Signaltransduktion
Eukaryontische Signaltransduktionssysteme besitzen eine enorme medizinische Relevanz, sind aber meist so komplex, dass sie sich bislang einer quantitativen Modellierung in toto entziehen. Auch hier bieten halophile Archaeen, besonders H. salinarum, ein ideales Modellsystem an, in welchem zwei targets die Endpunkte einer Signaltransduktionskette darstellen: der Flagellarmotor und das Genom. Zum Flagellarmotor führt ein so genanntes Zweikomponentensystem, dessen Aktivität durch die integrierte Aktivität von 18 verschiedenen Rezeptoren geregelt wird (Abb. 6). Ihre Raumstrukturen können mit den bekannten Teilstrukturen bakterieller Chemorezeptoren modelliert werden.
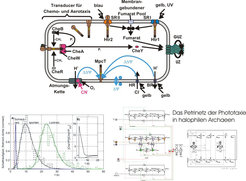
Einen neuen Rezeptortyp stellt der Membranpotenzialsensor MpcT dar [6]. Er vermittelt die Antwort der Zelle auf sich verändernde bioenergetische Bedingungen, indem er bei durch Fehlen von Licht oder Sauerstoff bedingtem sinkendem Membranpotenzial das Zwei-Komponenten-System aktiviert. Neun von den 18 Rezeptoren sind bisher in ihrer Funktion bekannt und insbesondere die Photorezeptoren Sensorrhodopsin I und II wurden in ihren molekularen Eigenschaften sehr genau charakterisiert. Durch die Möglichkeit, mithilfe einer automatischen Bewegungsanalyse jedes Detail der spontanen und lichtgesteuerten Antwort des Flagellarmotors und auch diesen selbst in seinem Rotationsverhalten zu modellieren, ist es in jüngster Zeit in Zusammenarbeit mit Wolfgang Marwan von der Universität Magdeburg und der Gruppe um Ernst-Dieter Gilles am Max-Planck-Institut für Dynamik komplexer Systeme gelungen, ein umfassendes Modell aller Lichtantworten und des Flagellarmotors zu erstellen, in welchem die wesentlichen Eigenschaften des Systems und alle bisher bekannt gewordenen Daten befriedigend simuliert werden können. Das Modell musste kürzlich auf Grund neuerer Daten erweitert werden und die Genom- und experimentelle Analyse zeigten, dass weitere Moleküle an der Signaltransduktion beteiligt sein müssen, sodass das Modell immer noch unvollständig ist.
Alle hier vorgestellten Ergebnisse zeigen, dass sich H. salinarum als Modellorganismus für die Systembiologie von Archaeen sehr gut eignet, und es ist zu hoffen, dass in näherer Zukunft die Module von Metabolismus, Bioenergetik und Signaltransduktion in ein erweitertes Modell überführt werden können, das diese drei Prozesse einheitlich umfasst.





